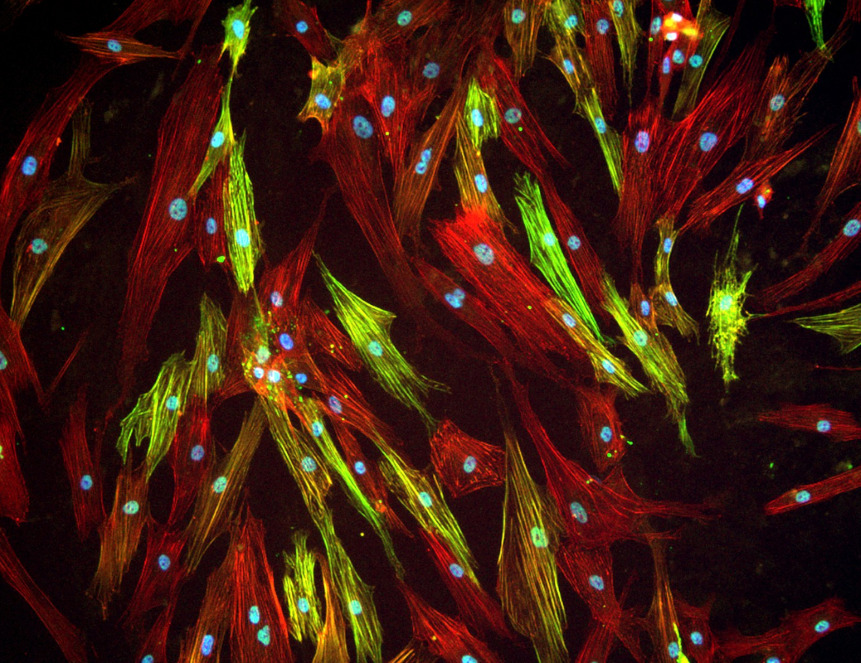
Ученые наиболее близко к естественным условиям смоделировали условия фиброза — разрастания рубцовой ткани на месте здоровой — в чашках Петри, вырастив в них стволовые клетки, а также клетки кожи и легких человека. Созданные условия — естественный белковый матрикс, синтезированный самими клетками, и добавление белка, способствующего развитию фиброза, — могут использоваться при поиске причин фиброза и разработке соответствующей терапии. Результаты исследования, поддержанного грантом Российского научного фонда, опубликованы в журнале Biochemical and Biophysical Research Communications.
Если сильно повредить кожу, после заживления раны образуется рубец. Похожий процесс, называемый фиброзом, происходит и в результате повреждения или воспаления внутренних органов и тканей — печени, легких, сердечной мышцы и других. На месте ранее специализированной ткани разрастается соединительная, которая не может выполнять функции той, что она заместила. Из-за этого органы начинают хуже работать. Согласно статистике, до 50% смертей в развитых странах связано именно с фиброзом, поэтому нужны подходы к его лечению. Чтобы их разработать, необходимо понимать причины и этапы замещения поврежденной ткани соединительной.
На сегодняшний день известно, что существует белок, способствующий фиброзу, — трансформирующий фактор роста бета (TGFβ-1). Кроме того, исследования показывают, что важную роль в разрастании клеток соединительной ткани играет состав внеклеточного матрикса — каркасных молекул, окружающих клетки. Однако до сих пор недостаточно доступных и корректных моделей, позволяющих воссоздать фиброз в клеточных культурах и подробно исследовать его причины.
Ученые из Московского государственного университета имени М. В. Ломоносова смоделировали фиброз на клеточных культурах, искусственно превратив стволовые клетки в миофибробласты — клетки соединительной ткани. Для этого авторы создали для стволовых клеток микроокружение, наиболее близкое тому, что возникает в ткани при начале развития фиброза. Стволовые клетки человека поместили на естественный матрикс — белки, которые в больших количествах синтезируются в соединительной ткани, — и добавили белок TGFβ-1.
Наблюдения показали, что спустя четыре дня выращивания на такой среде у стволовых клеток появлялись признаки основных клеток рубцовой ткани — миофибробластов. В них начали синтезироваться специфические белки — фактор активированных фибробластов и гладкомышечный актин. Кроме того, клетки вырабатывали в 3,5 раза больше профибротических (способствующих фиброзу) белков и примерно на 40% меньше антифибротических, чем культуры, выращенные в стандартной питательной среде без TGFβ-1 и других специфичных для соединительной ткани молекул.
Анализ регуляторных микроРНК — молекул, контролирующих активность различных генов, — показал, что в смоделированном микроокружении в клетках изменяется количество микроРНК, мишени которых связаны с фиброзом. Учитывая, что стволовые клетки способны передавать соседним клеткам сигналы в виде микроРНК, такие изменения способны влиять на судьбу не только самих стволовых клеток, но и их соседей.
Кроме того, авторы подтвердили, что в предложенных условиях в миофибробласты могут превращаться не только стволовые, но и уже специализированные клетки — кожи и ткани легкого. Благодаря этому в предложенных условиях можно будет моделировать развитие фиброза в разных тканях и искать наиболее эффективные для каждого случая методы терапии.
«Предложенный подход позволил нам уточнить некоторые молекулярно-клеточные механизмы развития фиброза. Кроме того, он может стать платформой для поиска и тестирования потенциальных препаратов для лечения патологического разрастания соединительной ткани. В дальнейшем мы планируем использовать разработанную нами систему для изучения взаимодействий различных типов клеток легкого при развитии фиброза», — рассказывает участник проекта, поддержанного грантом РНФ, Ольга Григорьева, кандидат биологических наук, научный сотрудник лаборатории репарации и регенерации тканей МГУ.
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.





