
Премия «Вызов», в научный комитет которой входит наш научный редактор Алексей Паевский, в номинации «Инженерное решение» в 2024 году была присуждена Сергею Таскаеву из Института ядерной физики имени Будкера СО РАН за разработку компактного ускорительного источника нейтронов, пригодного для широкого круга исследований, в том числе для нейтронозахватной терапии. Рассказываем, в чем суть и значение открытия российского ученого.
Лучевая терапия воздействует на опухоли ионизирующим излучением или потоком частиц высоких энергий. Она больше столетия входит в число стандартных инструментов врачей-онкологов. Во многих случаях этот метод незаменим. Но, как и у химиотерапии, у него есть недостаток: радиация наряду с опухолевыми клетками повреждает и здоровые. Решением мог бы стать метод, который убивал бы по возможности избирательно только клетки опухолей, но никак не влиял на окружающие здоровые ткани.
Такую технологию предложили в 1936 году — это бор-нейтронозахватная терапия (БНЗТ). Раковые клетки характеризуются ускоренным метаболизмом и высоким уровнем пролиферации по сравнению со здоровыми. Поэтому им нужно больше питательных веществ, включая аминокислоты, которые они активно поглощают через специализированные транспортеры. Борсодержащие препараты, такие как борфенилаланин (BPA), структурно имитируют натуральные аминокислоты и проникают в клетки через их транспортные системы. Поэтому препараты с содержанием изотопа бор-10 можно заставить накапливаться в опухоли. В результате концентрация бора в раковых клетках может в пять раз превысить его количество в здоровой ткани.
Если затем облучить опухоль потоком нейтронов, атомы бора-10 будут захватывать нейтроны, превращаться в изотоп бор-11, а затем распадаться на ядро атома лития, альфа-частицу, а также испускать гамма-кванты. Ключевой особенностью альфа-частиц и ядер лития является их очень короткий пробег в тканях, не превышающий 10 мкм. Это расстояние сравнимо с размером одной клетки, что делает действие реакции локализованным в пределах клеток, содержащих бор. Продукты этих распадов повреждают ДНК, клеточную мембрану, макромолекулы, такие как липиды или полисахариды, и в конечном итоге приводят опухолевую клетку к гибели.
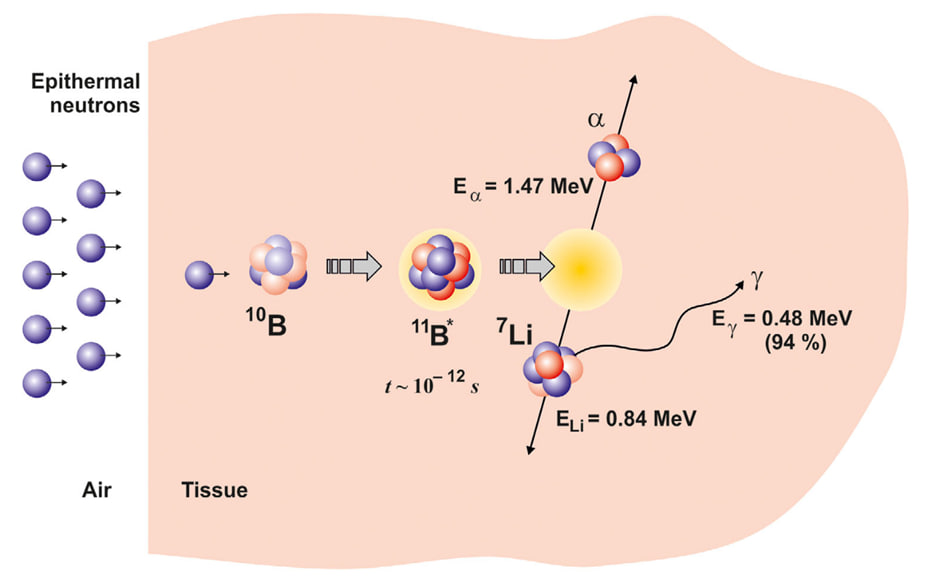
Рисунок 1. Принцип воздействия бор-нейтронозахватной терапии на злокачественные клетки
В 1950-е годы первые попытки использовать этот вид лечения опухолей проводили с помощью пучка нейтронов от ядерных реакторов. Только они могли выделить и обеспечить требуемый поток так называемых резонансных нейтронов нужной энергии (от 1 до 30 килоэлектронвольт), которые захватываются бором-10 с гораздо большей вероятностью, чем нейтроны других энергий. Их называют надтепловыми, или эпитепловыми, нейтронами.
Впрочем, ранние клинические испытания, которые проводились профессорами Фарром и Свитом в США с 1951 по 1961 год на специально построенных ядерных реакторах в Брукхейвенской национальной лаборатории и Массачусетском технологическом институте, не продемонстрировали терапевтическую эффективность метода. Причина заключалась в недостаточно эффективных борсодержащих препаратах, которые не могли обеспечить высокую концентрацию бора в опухолевых клетках. Из-за этого пациент получал высокое фоновое облучение, а терапевтический эффект при этом был минимальный.
В 1970–1980-е годы японский врач Хироши Хатанака одним из первых добился успехов в лечении злокачественных опухолей, проводя операции, а затем облучая пациента нейтронами прямо в здании ядерного реактора. Подобные эксперименты затем проводились на реакторах научных центров в США, Финляндии, Швеции, Голландии, Аргентины и Чехии. В России в 2000-х годах на исследовательском реакторе ИРТ в МИФИ совместно с Клиникой экспериментальной терапии Российского онкологического центра РАМН проводилось лечение собак с меланомой ротовой полости. Полная регрессия опухоли наблюдалась у 78% собак. Однако по политическим и экономическим причинам большинство этих программ было свернуто. Медики и ученые переключились на другой источник нейтронов — ускорители частиц.
Во всех ускорителях, в том числе и на Большом адронном коллайдере, заряженные частицы разгоняются под действием электрических и магнитных полей. Но нейтрон не имеет электрического заряда, поэтому на ускорителях сперва получают поток протонов (или дейтронов — ионов дейтерия), который затем бомбардирует мишень, где уже возникают нейтроны. Но физики, пытаясь создать ускорители для онкологов, столкнулись со множеством проблем. В частности, им не удавалось получить избирательно поток резонансных нейтронов в нужном интервале энергии: пучок не был достаточно интенсивен, а также мишень, генерирующая нейтроны, слишком быстро деградировала под действием потока протонов.
Ученые из Института ядерной физики имени Г.И. Будкера Сибирского отделения РАН под руководством Сергея Таскаева создали компактный ускорительный источник нейтронов нового типа. Установка, получившая название VITA, состоит из ускорителя и литиевой мишени, генерирует эпитепловые нейтроны, идеально подходящие для БНЗТ, и, благодаря небольшим размерам, может размещаться прямо в клинике.
Особенностью конструкции является отсутствие ускорительных труб, вместо которых используются промежуточные электроды в виде вложенных друг в друга соосных цилиндров, закрепленные на единственном проходном изоляторе.
«Такая конструкция напоминает кочан капусты, где кочерыжка — это проходной изолятор, а листья — электроды», — объясняет Сергей Таскаев в книге «Ускорительный источник нейтронов VITA».
Команда Таскаева расположила межэлектродные изоляторы подальше от пучка заряженных частиц для улучшения высоковольтной прочности установки, при этом в ускорительном зазоре ученым удалось обеспечить высокий темп ускорения и увеличить ток пучка ионов за счет близкого размещения электродов.
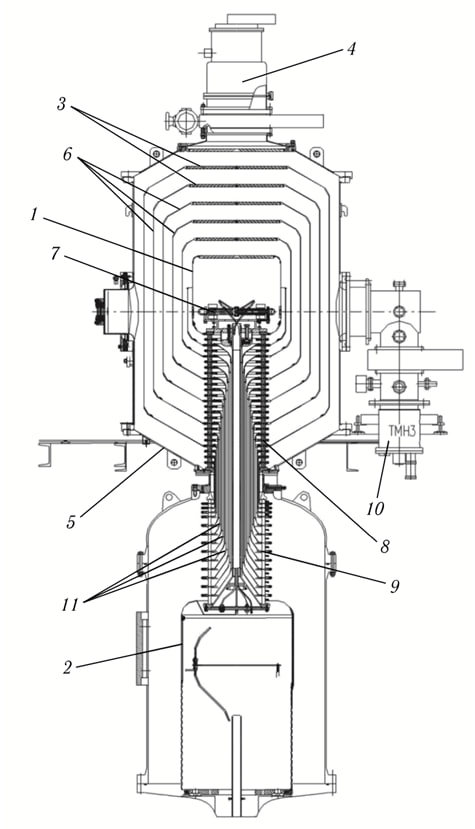
Рисунок 2. Общий вид электростатического 6-зазорного ускорителя-тандема с вакуумной изоляцией: 1 — высоковольтный электрод ускорителя; 2 — высоковольтный электрод источника постоянного напряжения; 3 — жалюзи электродов-экранов; 4 — криогенный насос; 5 — вакуумный бак ускорителя; 6 — промежуточные электроды-экраны ускорителя; 7 — газовая обдирочная мишень; 8 — вакуумная часть проходного изолятора; 9 — газовая часть проходного изолятора; 10 — турбомолекулярный насос; 11 — внутренние коаксиальные цилиндры
В ускоритель вводят отрицательные ионы водорода, которые разгоняются под действием постоянного электрического поля и попадают в газовую «обдирочную» мишень. Здесь происходит взаимодействие ионов с газом, чаще всего аргоном, что приводит к удалению электронов и формированию протонного пучка. На устройство обдирочной мишени Сергей Таскаев получил патент.
Хотя подобные газовые мишени в таких установках традиционно считались проблемными из-за сопутствующего образования нежелательных продуктов реакции, разработчики VITA смогли превратить этот элемент в одно из преимуществ конструкции. Благодаря обдирочной мишени ученым удалось повысить электрическую прочность установки, а также проводить диагностику пучка в реальном времени благодаря свечению, вызываемому взаимодействием пучка протонов с газом. При этом газовый десорбер выполняет основную функцию. Он обеспечивает до 95% конверсии отрицательных ионов в протоны. Это позволяет достигать высокой интенсивности протонного пучка (почти 10 миллиампер), необходимой для эффективной генерации нейтронов в литиевой мишени.

Рисунок 3. Пример изображений с видеокамеры (синим цветом виден ионный пучок, красным цветом видна нагретая диафрагма; справа изображение при токе протонов 9 мА)
Вторичные частицы, образующиеся в процессе взаимодействия с газом (например, положительно заряженные ионы аргона), были сведены к минимуму благодаря оптимизации давления в камере. Это обеспечило подавление вторичных частиц по отношению к току основного пучка в 2 тысячи раз. Пониженное давление в установке VITA поддерживалось на уровне 10-7 миллиметров ртутного столба, что значительно снижает вероятность взаимодействия протонов с остаточными молекулами газа. Это не только уменьшает генерацию вторичных частиц, но и минимизирует потери энергии основного пучка.
После обдирочной мишени ионы водорода — протоны — ускоряются тем же электрическим полем, что и инжектируемые отрицательные ионы водорода (поэтому эту схему называют тандемной) и попадают на литиевую мишень. Эта мишень состоит из нескольких слоев: тонкого слоя чистого лития — для генерации потока нейтронов, субстрата из меди — для эффективного отвода тепла, а также промежуточного слоя из тантала, устойчивого к радиационным повреждениям и образованию пузырьков водорода под поверхностью металла (блистерингу), которые уменьшают теплопередачу и могут привести к разрушению мишени.
Подобная конструкция обеспечивает длительную стабильную работу мишени и минимизирует загрязнение рабочей области радионуклидом бериллий-7, образующимся в результате реакции. Благодаря эффективному охлаждению и точной настройке мишень позволяет генерировать стабильный поток нейтронов, достаточный для лечения сотен пациентов.
В результате ученым удалось с помощью установки VITA получить стабильный поток нейтронов — около миллиарда на квадратный сантиметр в секунду с нужной для БНЗТ энергией при токе протонного пучка 10 миллиампер. При этом соотношение потоков тепловых и эпитепловых нейтронов составляет 1/30, а доли быстрых нейтронов и гамма-излучения пренебрежимо малы.
Помимо самой установки, группа Таскаева разработала препараты, содержащие наночастицы бора (eBNPs). Наночастицы бора обладают высокой способностью проникать в клетки опухоли благодаря эндоцитозу — процессу захвата внешнего материала клеткой путем образования мембранных везикул, что делает их накопление более эффективным, чем у традиционных препаратов. При этом наночастицы остаются в цитоплазме в течение всего времени облучения, обеспечивая стабильный терапевтический эффект. Кроме того, эти частицы обладают повышенной стабильностью в водных средах. Это упрощает хранение и применение препаратов в клинических условиях.

Рисунок 4. Ускорительный источник нейтронов VITA на площадке ИЯФ СО РАН
В ходе доклинических исследований, проведенных группой Сергея Таскаева в Институте ядерной физики СО РАН в 2022 году, источник VITA использовался для лечения животных с опухолями. Ученые фиксировали значительное уменьшение размеров опухолей, у животных восстанавливался аппетит и общее состояние. В том же году установка VITA начала работать в Китае, где проводятся клинические испытания на пациентах с опухолями головы и шеи. В России планируется внедрение технологии в ведущих онкологических центрах. На церемонии глава ФМБА России Вероника Скворцова, вручавшая премию Сергею Таскаеву, сказала, что установки на основе источника, созданного в Сибири, с 2025 года начнут работу в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» и затем в ФГБУ «НМИЦ им. В.В. Алмазова».
Хотя установка VITA разработана преимущественно для БНЗТ, ученые могут использовать ее и как инструмент для фундаментальных исследований, а также для других практических задач. В частности, при помощи VITA методом активационного анализа была измерена концентрация опасных примесей в образцах керамики, разработанных для Международного термоядерного реактора ИТЭР. Для другой задачи физики получили пучок дейтронов в ускорителе-тандеме, а на литиевой мишени осуществили генерацию мощного потока быстрых нейтронов в реакции 7Li(d,n). При помощи них физики измерили зависимость прозрачности оптического волокна трех типов от флюенса быстрых нейтронов для Центра ядерных исследований Сакле (Франция), а также исследовали радиационную стойкость полупроводниковых фотоэлектронных умножителей, dc-dc конвертеров для эксперимента ATLAS на Большом адронном коллайдере, алмазного детектора для ИТЭР и других устройств, в которых необходима радиационная стойкость. Кроме того, при помощи VITA ученые разрабатывают in situ метод стерилизации эндопротезов.
Фундаментальные исследования, которые ученые проводят на установке VITA, в большинстве случаев связаны с БНЗТ. Например, физики провели измерения выхода нейтронов и фотонов из литиевой мишени и сечений ядерных реакций 7Li(p, p′γ)7Li и 7Li(p, α)4He, полной информации о которых раньше не существовало. Полученные данные были внесены в международные базы данных ядерных реакций IBANDL и Exfor. Однако ученые используют VITA для получения знаний и о других важных реакциях — например, в настоящее время на установке проводят измерение сечения ядерной реакции 11B(p,α)αα, перспективной для безнейтронной термоядерной энергетики.
Текст: Дмитрий Рудик.
Материал предоставлен научным комитетом премии «Вызов».
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.





