Ученые разработали модель ожога роговицы у мышей, которая впервые позволила сравнить два исхода ее заживления: восстановление прозрачности и патологическое рубцевание, которое приводит к ухудшению и потере зрения. Оказалось, что при заживлении роговицы процессы появления и исчезновения миофибробластов — клеток, которые помогают затягивать раны, — определяют исход: регенерацию или формирование рубца. Полученные данные будут полезны при разработке новых способов лечения, стимулирующих регенерацию роговицы и предотвращающих слепоту. Результаты исследования, поддержанного грантом Российского научного фонда, опубликованы в журнале Experimental Eye Research.
Случаи химических ожогов роговицы — одна из самых сложных проблем в офтальмологии, поскольку они часто приводят к необратимым повреждениям тканей и потере зрения из-за формирования непрозрачных рубцов и врастания кровеносных сосудов в роговицу. Существующие методы лечения с помощью противовоспалительных (кортикостероидов) или предотвращающих рубцевание (например, митомицина С) препаратов часто оказываются недостаточно эффективными и могут вызывать серьезные побочные эффекты. Например, кортикостероиды повышают внутриглазное давление, увеличивают риск развития катаракты и инфекций. В тяжелых случаях единственным выходом остается пересадка роговицы, которая иногда заканчивается отторжением или помутнением трансплантата.
Разрабатывать эффективное лечение для таких состояний сложно, потому что существующие модели химического ожога, когда на глаз лабораторного животного наносят щелочь или кислоту, имеют погрешность измерений около 40%. Это связано с тем, что повреждающее вещество наносят недостаточно стандартизированными способами. Методики не учитывают количество реагента на фильтровальной бумаге (пористом материале, который используют как впитывающий носитель или фильтр для жидкостей) и в основном позволяют изучать только патологические случаи образования рубца, но не варианты заживления без помутнения роговицы. Поэтому, чтобы сравнивать два принципиально разных исхода заживления роговицы — восстановление прозрачности (регенерацию) и патологическое рубцевание, — а также разработать действенную терапию, нужны новые подходы.
Исследователи из Московского государственного университета имени М. В. Ломоносова усовершенствовали модель химического ожога роговицы у мышей. Ученые изменили стандартный протокол модели — вместо тонких, подверженных изгибу бумажных фильтровальных дисков они предложили использовать плотные диски, которые не меняют свою форму при пропитывании разными концентрациями гидроксида натрия. Поэтому, используя их, специалисты могут получить ожог с одинаковой площадью у всех подопытных мышей.
В эксперименте авторы использовали стандартизированные диски диаметром два миллиметра с однородной поверхностью, которую покрыли ровным слоем реагента. Перед нанесением на роговицу с дисков удалили избытки щелочи, что снизило ошибку эксперимента. Авторы использовали концентрации гидроксида натрия 20 и 40 грамм на литр, что позволило получить совершенно разные исходы заживления роговицы. Предполагалось, что ожог щелочью низкой концентрации приведет к регенерации раны, а высокой — к образованию рубца.
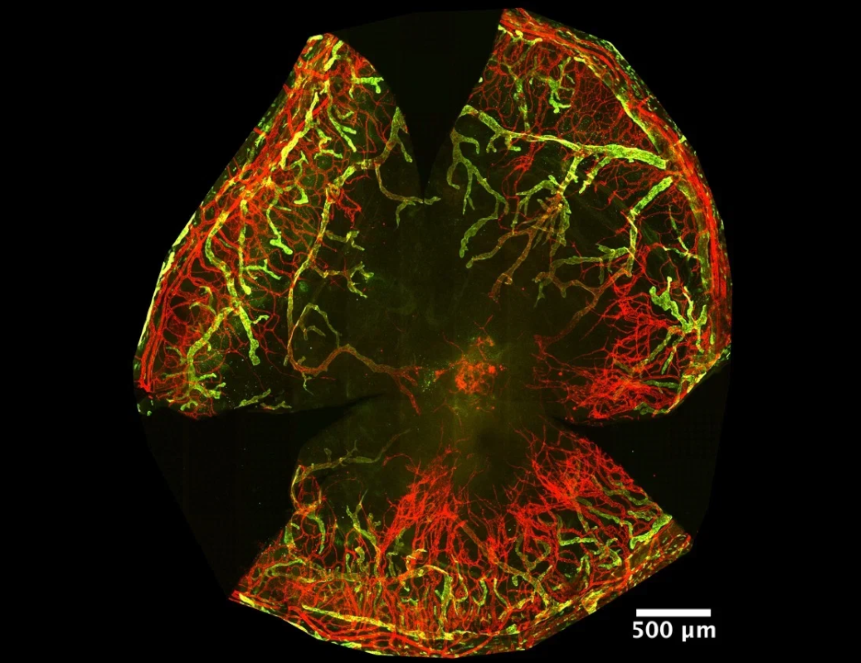
С помощью такой модели ученым удалось детально проследить клеточные и молекулярные изменения в роговице глаза лабораторных мышей. Оказалось, что при концентрации 20 грамм щелочи на литр количество миофибробластов — клеток, которые помогают затягивать раны, но также вызывают рубцевание, — снижалось уже через 7 дней после ожога. К 21-му дню эти клетки полностью исчезали, что сопровождалось восстановлением прозрачности.
При использовании щелочи с концентрацией 40 грамм на литр миофибробласты сохранялись и через 21 день, в том числе в эндотелии — внутреннем слое роговицы, — что сопровождалось ее помутнением. Высокая концентрация гидроксида натрия вызвала быстрое прорастание кровеносных и лимфатических сосудов в толстый слой роговицы, причем уже к 7-му дню эксперимента сосуды покрывались гладкомышечными клетками. Это привело к стабилизации сосудов и потере прозрачности роговицы.
Полученные данные важны для экспериментальной и практической медицины, так как позволяют глубже понять механизмы естественного восстановления роговицы после травм, дают возможность тестировать новые препараты для предотвращения ее рубцевания и открывают пути для разработки методов, ускоряющих регенерацию клеток роговицы.
«Мы уверены, что наша модель станет мощным инструментом для разработки принципиально новых методов лечения повреждений роговицы. Важным открытием стало обнаружение критической роли миофибробластов в процессе заживления. Мы смогли показать, что именно скорость их исчезновения определяет, восстановится ли прозрачность роговицы, или сформируется рубец. В дальнейшем мы планируем использовать предложенную модель, чтобы установить источник миофибробластов и выяснить, какие молекулярные и клеточные регуляторы могут определять различный исход заживления при повреждениях разной степени. Предположительно, мы можем использовать целый ряд подходов — от генной терапии до трансплантации клеток, — чтобы регулировать ход заживления и стимулирвать регенерацию при повреждении, которое должно вызывать формирование бельма», — рассказывает руководитель проекта, поддержанного грантом РНФ, Павел Макаревич, доктор медицинских наук, заведующий лабораторией медицинской биоинженерии Центра регенеративной медицины, доцент кафедры биохимии и регенеративной биомедицины факультета фундаментальной медицины МГУ.
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.