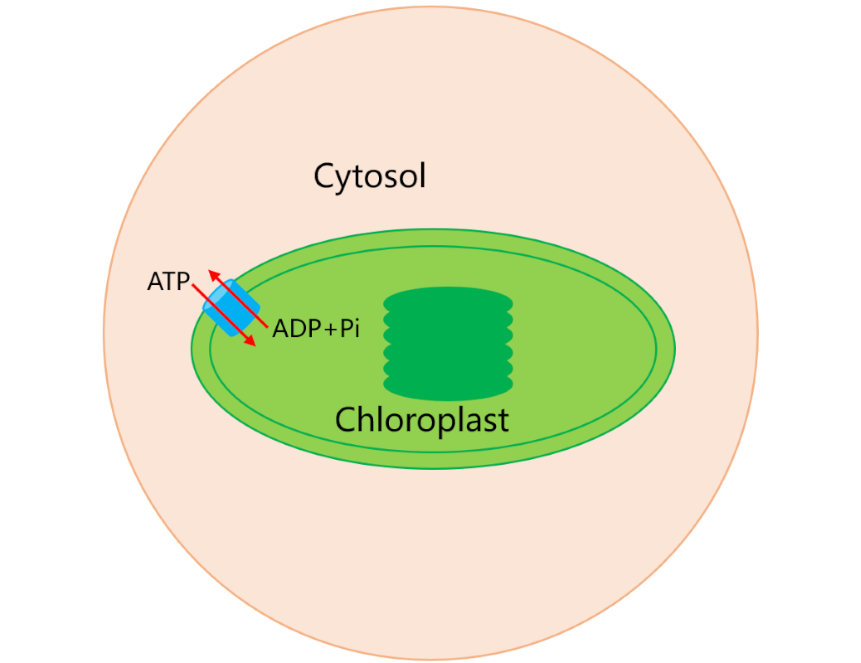
Китайские ученые раскрыли механизм энергетического обмена в хлоропластах — ключевых органеллах растений, ответственных за фотосинтез. Белок NTT в хлоропластах обеспечивает импорт АТФ из цитоплазмы для энергетических процессов, таких как фотосинтез, и одновременно экспортирует АДФ и неорганический фосфат (Pi), поддерживая энергетический баланс клетки. Открытие не только проливает свет на эволюцию растений, но и может помочь в повышении урожайности сельскохозяйственных культур и разработке новых лекарств против внутриклеточных патогенов. Исследование опубликовано в журнале Nature.
Хлоропласты играют важнейшую роль в энергетическом обмене растений, выполняя функции, схожие с функциями митохондрий в клетках животных. Однако если митохондрии используют белок AAC для экспорта АТФ (основной энергетической «валюты» клетки) в цитоплазму, то хлоропласты применяют другой белок — NTT, который, наоборот, импортирует АТФ из цитоплазмы для поддержания процессов фотосинтеза, синтеза крахмала и жирных кислот. Ученые долгое время задаются вопросом о происхождении этого белка. Согласно одной из гипотез, хлоропласты унаследовали NTT от древних бактерий, похожих на хламидии, которые могли «воровать» АТФ у своих хозяев.
Чтобы проверить гипотезу, ученые определили трехмерные структуры NTT-белков из хлоропластов растения Arabidopsis и бактерии Chlamydiapneumoniae с почти атомарной точностью (2,72–2,90 Å). Они обнаружили, что оба белка состоят из 12 трансмембранных спиралей и имеют схожую конформацию, что подтверждает их общее происхождение. Исследователи также идентифицировали сайты связывания АТФ, АДФ и неорганического фосфата (Pi) в структуре белка. Оказалось, что связывание АТФ происходит за счет взаимодействия трех его частей — аденина, рибозы и фосфатных групп — с аминокислотными остатками белка. При этом фосфатные группы АТФ и АДФ занимают разные положения, что влияет на расположение взаимодействующих с ними аминокислот. Позиция для связывания Pi точно соответствует положению гамма-фосфатной группы АТФ. Для подтверждения этих данных ученые провели эксперименты по обмену АТФ/АДФ с использованием хемилюминесценции и радиоактивных изотопов.
Результаты исследования показали, что NTT-белок работает по механизму «рокер-свитч», характерному для транспортеров из суперсемейства MFS (Major Facilitator Superfamily — семейство мембранных транспортных белков, которые облегчают перенос различных молекул через клеточные мембраны). Этот механизм предполагает, что N- и C-концевые домены белка двигаются относительно друг друга, открывая и закрывая транспортный путь для субстрата. Такая конформационная перестройка позволяет белку эффективно связывать и переносить АТФ или АДФ вместе с Pi через мембрану. Ученые также обнаружили, что мутация консервативного аспарагинового остатка (N282 в Arabidopsis AtNTT1) значительно увеличивает способность белка транспортировать другие нуклеотиды, такие как ГТФ, ЦТФ и УТФ. Это указывает на ключевую роль этого остатка в специфическом распознавании АТФ.
Открытие имеет не только важное значение для фундаментальной науки, но и перспективы практического применения. Понимание механизма работы NTT-белка может помочь в создании генетически модифицированных растений с повышенной урожайностью, а также в разработке ингибиторов для борьбы с внутриклеточными патогенами, такими как хламидии. Дальнейшие исследования могут быть направлены на изучение эволюции NTT-белков у других организмов и разработку новых методов управления энергетическим обменом в клетках.
Автор: Богдан Скиба.
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.





