Американские ученые составили генетическую карту паразита человека и обезьян Plasmodium knowlesi — возбудителя малярии. С помощью метода транспозонного мутагенеза исследователи определили набор важных для жизни паразита генов, в том числе генов, ответственных за устойчивость P. knowlesi к препаратам. Полученные сведения могут помочь в дальнейшей разработке лекарств и вакцин против малярии. Исследование опубликовано в журнале Science.
Малярия остается одной из самых опасных инфекционных болезней: ежегодно малярией заражаются 249 миллионов людей по всему миру, 680 тысяч заболевших умирают. Основными возбудителями являются одноклеточные паразиты из рода Plasmodium, такие как P. falciparum и P. vivax. В последние годы также участились случаи заражения P. knowlesi — паразит передается человеку от обезьян через укусы комаров. Борьба с малярией представляется сложной задачей из-за ограниченного арсенала имеющихся лекарств и возрастающей по мере развития P. knowlesi как биологического вида устойчивости к этим лекарствам. Методы, которые ученые используют в новейших исследованиях, позволяют идентифицировать ключевые для протекания жизненного цикла паразита гены, что открывает новые возможности для разработки медикаментов. В новой работе исследователи использовали метод транспозонного мутагенеза, который позволил составить генетическую карту P. knowlesi, отражающую функциональную значимость генов паразита.
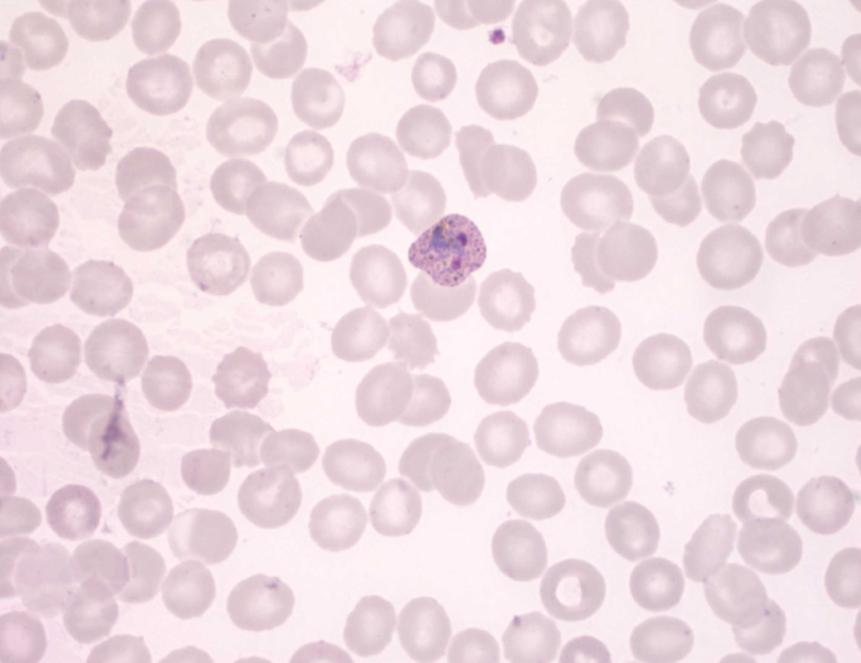
Для идентификации необходимых для успешной жизнедеятельности малярийного плазмодия генов ученые использовали метод транспозонного мутагенеза, известный как piggyBac. Эксперименты проводили на эритроцитарной стадии жизненного цикла паразита, на которой плазмодий инфицирует эритроциты и размножается внутри них. Суть метода piggyBac заключалась в том, что транспозон (мобильный участок ДНК) случайным образом внедряли в геном P. knowlesi. Если транспозон попадал в важный участок генома, плазмодий не мог нормально развиваться. Если же нарушений развития не происходило, ученые делали вывод о том, что данный ген не имеет критического значения для жизни паразита. Ученые осуществляли мутагенез клеток P. knowlesi, развивающихся в эритроцитах макак Macaca mulatta, так как эритроциты этого животного больше подходят плазмодиям, чем человеческие. С помощью метода количественного секвенирования ученые определяли, в какие участки ДНК встраивался транспозон. На основе множества вставок исследователи определили, какие гены участвуют в развитии паразита, а какие нет. Этот метод позволил получить наиболее полную генетическую карту малярийного плазмодия P. knowlesi, содержащую информацию о значимости тех или иных генов для жизнедеятельности паразита.
«Знание всех основных генов P. knowlesi позволяет нам понять молекулярные стратегии, которые использует паразит для роста, реагирования на изменения окружающей среды и на терапевтические средства, такие как противомалярийные препараты. Это поможет ученым в разработке и проведении исследований малярии, а также в разработке стратегий мониторинга и ограничения возникновения лекарственной устойчивости», — заявила Шина Дасс из Гарвардской школы общественного здравоохранения им. Т. Х. Чана.
Всего ученые проанализировали 5266 генов Plasmodium knowlesi, из которых 2037 (38,7%) были охарактеризованы как жизненно важные (если их выключить, паразит погибает), 2124 (40,3%) — как необязательные (паразит выживает, даже если их выключить) и 1105 (21%) — как неопределенные (их роль пока не ясна). В дополнение к этому ученые выявили 126 генов, которые снижают выживаемость плазмодия при мутациях, 122 гена, которые можно отключить частично без потери жизнеспособности паразита, и 53 длинные некодирующие РНК, важные для развития.
Исследователи также обнаружили интересные особенности, связанные с метаболизмом P. knowlesi. В отличие от, например, P. falciparum, P. knowlesi сильно зависит от цикла трикарбоновых кислот (ЦТК) и, следовательно, более чувствителен к ингибитору фермента аконитазы — натриевому фторуксусу.
Также исследование показало, что P. knowlesi реагирует на препараты иначе, чем P. falciparum. Например, ген FPP/GGPPS, важная мишень для лекарств у P. falciparum, не играет значимой роли у P. knowlesi. Это объясняет, почему некоторые лекарства, эффективные против одного вида паразита, могут не работать против другого.
Полученные данные могут помочь в разработке новых препаратов для борьбы с возбудителями малярии, устойчивыми к существующим лекарствам. Обнаруженные различия в метаболизме P. knowlesi и P. falciparum также дают новые возможности для создания методов лечения, направленных на конкретные молекулы и механизмы, играющие ключевую роль в развитии заболевания.
Автор: Богдан Скиба.
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.