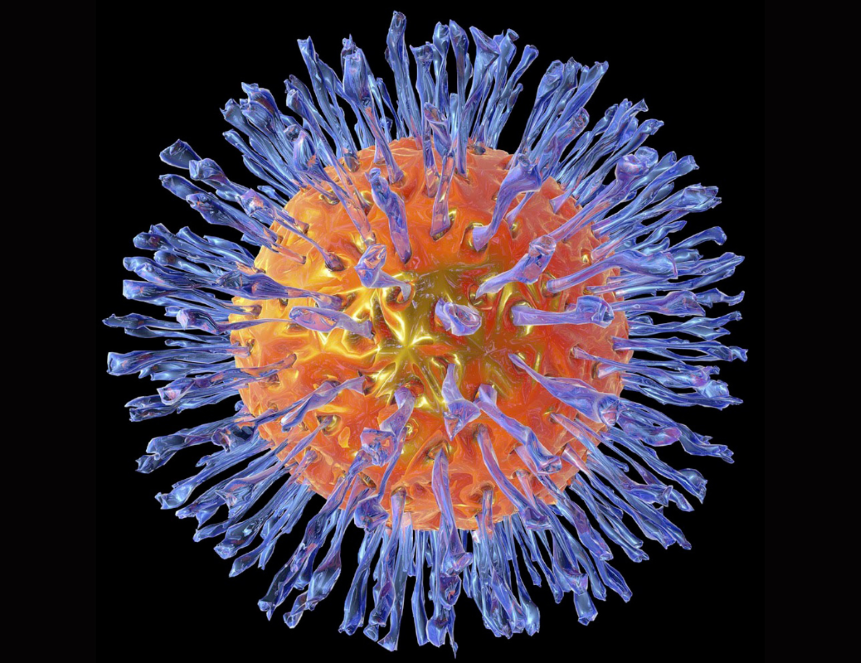
Ученые раскрыли ключевой молекулярный механизм, лежащий в основе патогенеза, то есть развития заболевания, цитомегаловируса (герпесвирус человека тип 5) — опасного возбудителя, вызывающего тяжелые врожденные пороки у детей и представляющего серьезную угрозу для людей с ослабленным иммунитетом. Оказалось, что ранее неизвестный молекулярный комплекс не только помогает вирусу проникать в клетки кровеносных сосудов, но и позволяет ему ускользать от иммунной защиты организма. Исследование, объясняющее многолетние неудачи в разработке вакцины против возбудителя цитомегаловирусной инфекции (ЦМВИ), опубликовано в журнале Nature Microbiology.
Цитомегаловирус, или герпесвирус человека тип 5 (ГВЧ-5), — широко распространенный представитель семейства герпесвирусов, пожизненно сохраняющийся в организме большинства взрослых людей. Хотя у многих инфекция протекает бессимптомно, она остается крайне опасной: в США примерно один из каждых 200 новорожденных появляется на свет с врожденной цитомегаловирусной инфекцией, и у каждого пятого из них развиваются тяжелые осложнения, такие как потеря слуха или задержка развития. Вирус также представляет смертельную опасность для пациентов после трансплантации органов и людей с иммунодефицитами. Основная сложность в борьбе с ГВЧ-5 заключается в крупном размере его генома и разнообразии способов заражения. Особенно сложно лечить вирус из-за того, что он проникает в эндотелиальные клетки, выстилающие сосуды, что способствует развитию сосудистых нарушений. Все предыдущие попытки создать эффективную вакцину или терапию оказались безуспешными, во многом из-за недостаточного понимания того, какие вирусные белки участвуют в этом процессе и как вирусу удается обманывать иммунную систему.
Чтобы раскрыть эти механизмы, международная команда исследователей провела детальный анализ поверхности вирусных частиц ГВЧ-5. С помощью современных биохимических методов ученые выделили основные белковые комплексы и определили их строение. Ключевым инструментом стала криоэлектронная микроскопия, позволившая получить трехмерную структуру вирусных белков с рекордным разрешением в 3,5 Å (3,5 ангстрема, или 0,35 нм). Особое внимание авторы уделили комплексам, содержащим гликопротеин H (gH), который представляет собой основной белок, используемый всеми герпесвирусами для проникновения в клетки, но с неизвестными для ГВЧ-5 партнерами.
В результате ученые обнаружили на поверхности вирионов (вирусных частиц) ГВЧ-5 новый, ранее не описанный белковый комплекс. Вместо привычного партнера gH — белка gL — вирус использует два других белка: UL116 и UL141. Новый комплекс получил название GATE (gH-associated tropism and entry complex). Структура, полученная методом крио-ЭМ с разрешением 3,5 Å, показала его уникальное устройство: белок gH служит основой, UL141 отвечает за димеризацию комплекса (соединение двух копий), а UL116 формирует плотную «шапочку», покрытую множеством молекул сахаров (гликанов). Особенно интересен UL141, ранее известный только как «иммуноэвазин», действующий внутри клетки для подавления иммунного ответа. Теперь стало ясно, что UL141 выполняет двойную функцию: он также присутствует на поверхности вируса, способствуя проникновению в эндотелиальные клетки и, вероятно, маскируя вирус от иммунной системы уже на этапе входа. Это объясняет, почему комплекс GATE играет роль «альтернативного ключа» для заражения именно сосудистых клеток.
Открытие комплекса GATE объясняет, почему прежние вакцины, нацеленные на другие вирусные белки (включая gH в комплексе с gL), не обеспечивали надежной защиты — вирус просто использовал «обходной путь» через GATE. «Если мы не знаем, каким оружием пользуется враг, трудно защититься от него. Мы нашли недостающий фрагмент пазла, который, возможно, объясняет, почему вакцинация против ГВЧ-5 не работала», — подчеркнул Джереми Камил из Университета Питтсбурга, США.
Новый комплекс может стать перспективной мишенью для разработки вакцин и противовирусных препаратов нового поколения, способных блокировать проникновение вируса в эндотелиальные клетки и его уклонение от иммунного ответа. Крис Бенедикт из Института Ла-Хойя, США, заключил: «Мы надеемся, что новые стратегии, нацеленные на GATE, повысят наши шансы в борьбе с цитомегаловирусной инфекцией и, возможно, позволят избавиться от нее». Более того, открытие позволяет предположить, что другие герпесвирусы, такие как вирус Эпштейна — Барр или вирус ветряной оспы, могут использовать схожие механизмы, что открывает новые горизонты для борьбы и с ними.
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.