Исследователи МФТИ вместе с российскими и зарубежными коллегами создали программу, которая генерирует математическую модель, описывающую электрическое возбуждение клеток сердца конкретного пациента. В новом исследовании, опубликованном в журнале PLOS ONE, ученые описывают два возможных подхода к решению задачи — в первом случае используются экспериментальные записи электрической активности, а в другом профиль экспрессии генов.
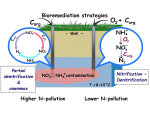
Перед каждым сокращением сердца происходит электрическое возбуждение, которое обусловлено электрическими токами в ионных каналах. Количество таких каналов различается — изменения могут быть вызваны как заболеваниями, так и непаталогическими индивидуальными особенностями разных тканей сердца. Нарушение баланса между ионными токами различного типа может стать источником опасных аритмий и даже смерти.
Из-за большого количества факторов, которые влияют на распространение возбуждения, общие принципы развития аритмий ученые исследуют с помощью математических моделей. Но несмотря на развитие этого подхода в течение полувека и постепенное усложнение моделей, они до сих пор редко применяются в клинической практике. По большей части это происходит из-за того, что модели описывают «среднего» пациента. Для каждого конкретного человека модель нужно менять, но до сих пор это было почти невозможно.
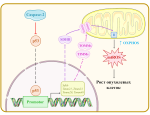
В новой статье ученые представили два подхода к такой персонализации. Первый использует экспериментальные записи формы потенциала действия и оптимизирует модель с помощью специальных компьютерных алгоритмов. Такие программы используют эволюционные алгоритмы для поиска таких параметров, при которых модель воспроизводит эксперимент. В более ранних работах исследователи показали, что недостаток такого подхода заключается в сложности поиска уникального решения: существует множество комбинаций параметров, при которых форма потенциала действия одинакова.
Второй метод связан с использованием данных экспрессии генов. Каждый ионный канал на клеточной мембране состоит из белковых субъединиц, которые встраиваются в мембрану клеток после трансляции с матричной РНК. Количество мРНК, которая экспрессируется, можно измерить, однако до сих пор ученые не могли предсказать электрофизиологические особенности пациента на основе этой информации. Чтобы сделать это теперь, авторы откалибровали модель с использованием разработанных алгоритмов на одном из пациентов. После этого на основе разницы профилей экспрессии исследователи разработали математические модели, которые успешно предсказали форму потенциала действия других пациентов по их индивидуальному профилю экспрессии генов.
«Мы рассмотрели каждый из этапов работы алгоритма и провели их оптимизацию. В предыдущих исследованиях параметры модели "мутировали" независимо друг от друга. Мы же использовали “векторную мутацию”, которая действует на все параметры одновременно. Так поиск требуемой параметризации модели идет значительно эффективнее. Вместе с другими улучшениями получился алгоритм, который позволяет определить проводимости основных ионных каналов с высокой точностью», — говорит один из авторов работы, сотрудник лаборатории физиологии человека МФТИ Андрей Пикунов.
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.