В последние годы термогенетика, изучающая возможность управления нейронными процессами с помощью тепла, становится все более популярной в нейробиологии и медицине. Исследования показывают, что термочувствительные ионные каналы, такие как человеческий TRPV1, обладают потенциалом для применения в терапии неврологических заболеваний. В недавнем исследовании, опубликованном большой группой российских ученых в журнале Cellular and Molecular Life Science, ученые показали, что человеческий терморецептор hTRPV1 вполне пригоден в качестве термогенетического инструмента для клинической нейромодуляции.
В нынешнем году исполняется 20 лет такому популярному методу воздействия на нейроны, как оптогенетика. В этом методе в мембрану нейронов различными генноинженерными методами встраиваются светочувствительные белки — родопсины. Таким способом, посветив на клетку лазерным лучом нужной длины волны, мы можем «включить» или «выключить» нужный нейрон. Смело можно сказать, что оптогенетика привела к революции в методах нейронаук, и ее создатели наверняка получат рано или поздно Нобелевскую премию. Однако у оптогенетики есть несколько важных ограничений, которые мешают широкому применению оптогенетики в клиническом поле.
Во-первых, мозг непрозрачен, поэтому для активации сколь-нибудь глубоких слоев нужно «прорубать» окно для световода. Во-вторых, белки, которые встраиваются в мембрану, — чужеродные (чаще всего это бактериальные родопсины). Поэтому их не оставляет без внимания иммунная система.
Менее десяти лет назад российский исследователь Всеволод Белоусов с коллегами предложили альтернативный метод — термогенетику: встраивание в нейроны термочувствительных белков семейства TRPV, за открытие которых Дэвид Джулиус и Арден Патапутян в 2021 году получили и премию Кавли, и Нобелевскую премию. Здесь нейрон достаточно нагреть, чтобы он сгенерировал потенциал действия. Это можно сделать ИК-лазером или направленным ультразвуком.
В первых экспериментах использовались TRPV-каналы гремучей змеи, на основе чего работает ее «тепловизор», с которым она охотится. Однако в этом случае проблема иммунной системы остается актуальной.
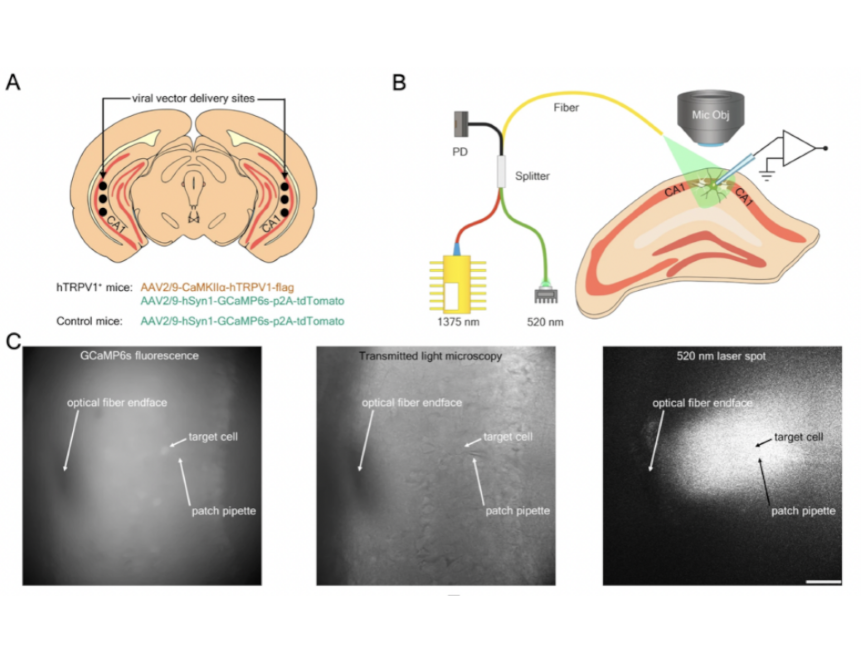
В новой работе авторы продемонстрировали (пока что на мышах), что термогенетическое управление поведением животного возможно и с человеческим рецептором. Авторами статьи стал большой коллектив российских ученых, первым автором выступил Дмитрий Мальцев, представляющий Институт биоорганической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова РАН и Федеральный центр мозга и нейротехнологий ФМБА России. Был среди авторов статьи и создатель метода, ныне — член-корреспондент РАН, директор Федерального центра мозга и нейротехнологий ФМБА России Всеволод Белоусов.
В своей работе авторы использовали человеческий термочувствительный канал hTRPV1. Они последовательно показали работоспособность термогенетических методов сначала in vitro (на культурах нейронов), затем — на живых срезах, а затем — на живых мышах. На культурах клеток и срезах было показано, что нейроны с человеческим рецептором отвечают активностью на нагрев до безопасной для клеток температуры, что очень важно для клинического применения; на мышах же уже проводили поведенческие эксперименты.
Животным вводили в нейроны клиновидного ядра продолговатого мозга, отвечающего за движение, гены TRPV1 и кальциевого датчика, который позволяет визуализировать изменения уровня кальция в клетках. Это позволяет оценить нейронную активность в реальном времени. К этому же ядру подводили волновод инфракрасного лазера. В результате включение лазера приводило к началу движения мыши, выключение — к остановке движения.
Повторяющиеся сессии термогенетической активации не вызывали деградации нейронного ответа, что указывает на возможность применения этого метода в длительной терапии. TRPV1 может стать новым инструментом для лечения различных неврологических заболеваний, включая эпилепсию и двигательные расстройства.
Текст: Алексей Паевский, Иван Долгих.
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.





