Японские ученые определили структуру шести состояний фермента АТФазы у бактерии Enterococcus hirae, которая способна расщеплять АТФ. Благодаря этому в будущем данный фермент может стать мишенью для лечения бактериальной инфекции. Исследование опубликовано в журнале Communications Biology.
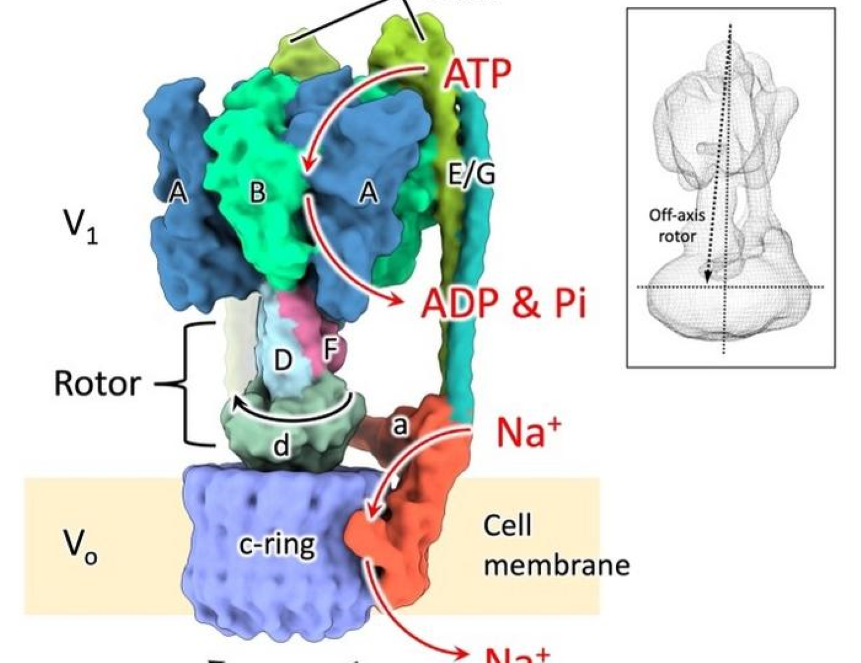
АТФ (аденозинтрифосфат) — это молекула, которая используется организмами как универсальный источник энергии. Во всех организмах также есть особые ферменты, которые нужны для синтеза АТФ (АТФ-синтазы) или для расщепления АТФ (АТФазы). Они имеют схожую структуру. Та часть фермента, которая находится вне мембраны, нужна для расщепления или синтеза АТФ, тогда как мембранная часть ответственна за транспорт ионов. Обе эти части связаны между собой тонким «стебельком» — ротором.
Японские ученые исследовали EhV-АТФазу бактерии Enterococcus hirae. Внешняя часть этого фермента называется V1, а мембранная — VO. При расщеплении АТФ ротор в центре фермента начинает вращаться, приводя в движение С-кольцо, которое нужно для транспорта ионов натрия из клетки и находится в VO-части. V1-часть при этом состоит из трех симметрично расположенных доменов расщепления АТФ, которые вращают ротор на 120° при постепенном расщеплении АТФ.
Ранее ученые проводили эксперименты по визуализации этой АТФазы, пометив ее золотой наночастицей, и обнаружили, что между каждыми основными паузами (состояния 1–3) есть промежуточные паузы (состояния 1’–3’), которые располагаются в 40° от основных. Кроме того, EhV-АТФаза содержит крупное С-кольцо, как V-АТФаза у высших организмов, однако оно не соединено с ротором напрямую никаким белком, поэтому до сих пор не было понятно, как именно ротор приводит С-кольцо в движение.
Чтобы разрешить эту загадку, ученые визуализировали движение EhV-АТФазы с помощью криоэлектронной микроскопии. Они смогли получить структуры всех шести состояний фермента. Ученые обнаружили, что в состояниях 1 и 2 ротор останавливается при вращении на 120°, но в состоянии 3 есть отклонение на -10° от ожидаемого угла вращения ротора. Помимо этого, ученые заметили крупные отклонения от предполагаемого угла вращения в промежуточных паузах: +13° (состояние 1’), +32° (состояние 2’), +28° (состояние 3’). Оказалось, что край ротора отходит из центра С-кольца и касается одного из его краев, таким образом приводя его в движение.
Ученые также показали изменение структуры части V1 при связывании АТФ и АДФ. Ранее считалось, что у этого белкового комплекса есть три состояния: «закрытое» (связывает АТФ), «полузакрытое» (связывает АДФ после расщепления АТФ) и «открытое» (не связывает ни АТФ, ни АДФ). Исследователи смогли подтвердить существование таких структур в основных паузах. Однако во всех промежуточных паузах (кроме состояния 2’) этот белковый комплекс находится в состояниях, когда во всех АТФ-связывающих доменах находится либо АТФ, либо АДФ.
Результаты исследования позволили сделать выводы об изменении структуры EhV-АТФазы. На основе этого можно подобрать ингибиторы этого фермента или придумать, как его модифицировать. Благодаря этому этот фермент в будущем может стать мишенью для лечения бактериальных инфекций.
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.





