Немецкие исследователи изучили процесс разрыва связи между белками биотином и стрептавидином с помощью улучшенного метода атомно-силовой микроскопии. В результате ученые обнаружили наличие нового типа трения в системе двух белков, которое зависит от направления. Исследование поможет лучше понять биофизический аспект поведения белков. Статья опубликована в журнале Nano Letters.
Белки играют важную роль в организме. В первую очередь, они — главный элемент клеточной машины. Белки участвуют во множестве биологических процессов: катализ реакций, обмен веществ, передача сигналов, транспорт. Благодаря своей многофункциональной роли белки являются основой существования всех живых организмов. Для работы белка требуется большое количество энергии, которая частично рассеивается во время процесса. Причиной этого становится белковое трение. Ученые знают о существовании «внутреннего» белкового трения, которое возникает в результате колебаний внутри белка. Трение также появляется при взаимодействии белка с растворителем, когда молекулы растворителя ускоряются. Эти источники трения приводят к определенному нагреву белка. Бывает, что трение используется в биологической системе как основной, а не побочный процесс. Когда специальный моторный белок движется по скользящим микротрубочкам внутри клетки, то возникает трение, противодействующее скольжению. Этот процесс необходим для транспорта — переноса вещества за пределы одной клетки.
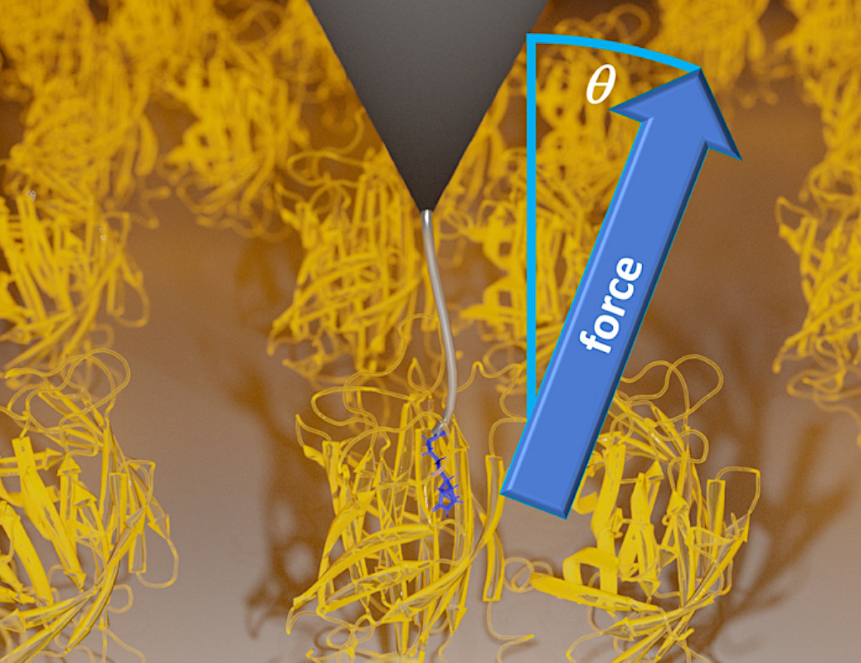
В своем новом исследовании группа ученых из Фрайбургского университета и Института биофизики Общества Макса Планка описала новое трение в белках, возникающее в системе «белок — лиганд». Для этого они использовали распространенное сочетание биотина и стрептавидина — двух белков, обладающих высоким сродством друг к другу. Их связь ученые охарактеризовали с помощью метода крупнозернистого моделирования, при котором атомы моделируются не по отдельности, а целыми группами. Такие группы атомов ученые объединяют и рассматривают как одно целое, например как «целые» аминокислоты. Это было необходимо из-за сложности структуры белка — это высокомолекулярное соединение, состоящее из множества аминокислот, которые объединяют длинные химические связи. Затем ученые использовали стереографическую силовую спектроскопию одной молекулы (stereographic single molecule force spectroscopy, SMFS), основанную на атомно-силовой микроскопии. Так авторы работы смогли изучить поверхностное отсоединение лиганда от белка сразу по всем трем декартовым координатам.
В ходе эксперимента группа ученых обнаружила, что процесс разрыва связи «белок — лиганд» сопровождается трением. Когда эти два белка разъединяются, то они как бы «вытягиваются», чтобы оторваться друг от друга. Чтобы один белок вытянулся относительно другого, к системе необходимо приложить силу тяги, превосходящую трение. Исследователи выяснили, что сила трения зависит от точного направления приложения силы тяги, то есть от угла, под которым белок вытягивается. Причиной трения была случайная ориентация белков вдоль их осей вращения. Эта ориентация не может быть заранее определена ни в эксперименте, ни в реальном мире, и каждое измерение силы трения будет давать разный результат. Поэтому каждый раз белок поглощает разное количество энергии, ведь энергия вынуждена частично рассеиваться в виде тепла. Такое трение, зависящее от направления, называется анизотропным трением. До сих пор ученые не знали, что трение в биологических молекулах может зависеть от направления.
Трение в системе «белок — лиганд» способно вызывать термодинамические изменения, что может приводить к изменениям в конформации белка или его активности. «Мы предполагаем, что этот ранее неизвестный и фундаментальный тип трения присутствует в каждой системе, где случайность в ориентации белков проявляется вместе с направленностью приложения силы», — рассказал Бизан Бальцер из Фрайбургского университета, биофизик и соавтор исследования. По его словам, это можно применить к молекулярным двигателям или даже к кровотоку. Таким образом, изучение анизотропного трения в белках является еще одним шагом к пониманию фундаментальных физических взаимодействий в биологических системах.
Автор: Нелли Чивилева.
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.