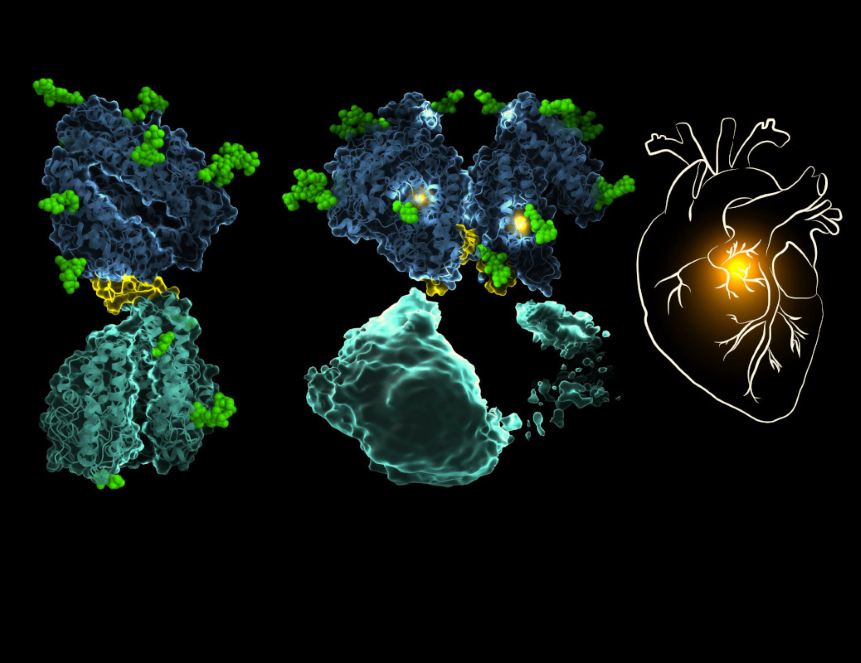
Ученые из Кейптаунского университета (ЮАР) впервые показали структуру ангиотензинпревращающего фермента — белка, регулирующего кровяное давление. Он является мишенью для лечения гипертензии. Исследование опубликовано в журнале The EMBO Journal.
Ангиотензинпревращающий фермент (АПФ) — это внеклеточный фермент, который связан с ангиотензином. Это гормон олигопептидной структуры, который существует в двух формах — ангиотензин I (пептид из 10 аминокислот) и ангиотензин II (пептид из 8 аминокислот). АПФ переводит первую форму во вторую, отщепляя от полипептида две аминокислоты. Ангиотензин II участвует в сужении сосудов, вызывая повышение давления. Поэтому АПФ считается основной мишенью для регуляции активности этого гормона, что особенно важно при лечении гипертензии и других сердечно-сосудистых заболеваний.
Теперь исследователи впервые смогли показать структуру АПФ, используя метод криоэлектронной микроскопии. Для этого белок замораживали при температуре -180 °С. Благодаря этому ученые показали, что мономерная форма АПФ состоит из двух доменов, которые схожи по структуре, но имеют различные функции. Эти домены связаны между собой. Кроме того, АПФ может существовать в димерной форме. В исследовании описан механизм димеризации, а также подробности о связи разных доменов фермента между собой.
Для лечения гипертензии используются препараты, ингибирующие активность АПФ. Их минусом является то, что они лишены селективности, поэтому у некоторых пациентов такие препараты вызывают побочные эффекты. Определение структуры АПФ позволяет определить участки фермента, которые могут стать мишенью новых лекарств направленного действия.
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.