Международная группа ученых выявила механизм развития ряда генетических заболеваний, при которых нарушается структура белков и они конденсируются в ядрышке клетки, нарушая его функции. Хотя знания механизма недостаточно для нахождения лекарства от таких болезней, новые сведения могут быть полезны также при изучении опухолей. Исследование опубликовано в журнале Nature.
При синдроме BPTAS, название которого объединяет в себе ряд медицинских названий симптомов, у людей наблюдаются пороки развития нервной системы, костей конечностей и черепа. Часто у таких людей короткие пальцы на руках, дополнительные пальцы на ногах, у них могут отсутствовать большеберцовые кости и уменьшается объем мозга. Это заболевание является ультраредким: сейчас в мире задокументировано всего 10 случаев. При этом механизм развития синдрома до сих пор не был понятен.
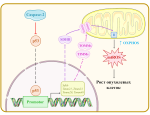
Ученые попытались выяснить причину развития синдрома BPTAS. Для этого они исследовали геномы пяти людей с таким синдромом и обнаружили во всех из них одинаковую мутацию в гене HMGB1. Он кодирует белок, который участвует в организации генетического материала в ядре клетки и облегчает взаимодействие ДНК с другими молекулами. В экспериментах на мышах ученые показали, что полное отсутствие этого гена в обеих хромосомах катастрофично, так как из-за этого погибает эмбрион. Однако если мутация в гене присутствует только на одной из хромосом, то наблюдается только некоторое отставание в развитии мозга. При этом разные мутации в гене HMGB1 имеют разные последствия для организма, но при синдроме BPTAS важна только одна из них. Дело в том, что из-за нее сдвигается рамка считывания последней трети гена. Из-за этого аминокислоты в конце белка имеют не отрицательный заряд, как положено, а положительный. Такой сдвиг рамки считывания может произойти, если из последовательности ДНК удалить любое число «букв» (нуклеотидов), которое не кратно трем. Интересно, что хвостовая часть белка не входит в его общую структуру, а расположена достаточно свободно. Функции таких белковых хвостов трудно изучать, так как обычно они имеют значение только при взаимодействиях с другими молекулами.
Чтобы понять, как изменение структуры хвоста белка HMGB1 может привести к развитию заболевания, исследователи обратились к биохимикам, которые работают с клеточными конденсатами. Это капли с высоким содержанием белков, которые выполняют схожие функции. В образовании таких конденсатов часто играют роль белковые хвосты: молекулы могут сцепляться ими друг с другом, из-за чего их трудно разъединить. Технически клеточным конденсатом является и ядрышко — структура в ядре клетки. Обычно в ядрышко попадают белки с положительно заряженными хвостами. В основном такие молекулы так или иначе связаны с процессом синтеза белка и другими важными клеточными функциями. Соответственно, мутантная форма белка HMGB1 с положительным, а не отрицательным зарядом на хвосте тоже оказывается в ядрышке. Однако хвост этого белка является неполярным, поэтому происходит агрегация белка. Из-за этого нарушается структура ядрышка, оно затвердевает. Это можно увидеть под микроскопом. В результате нарушаются жизненно важные функции клеток. Ученые доказали это, показав, что при наличии мутации в культуре погибает больше клеток, чем при ее отсутствии.
Авторы работы также исследовали базы данных, в которых содержатся геномные данные тысяч людей. Они пытались найти схожие случаи. В итоге ученым удалось найти больше 600 подобных мутаций в 66 белках. При этих мутациях тоже смещалась рамка считывания, из-за чего белки приобретали положительно заряженный хвост. 101 мутация среди найденных ранее была связана с различными болезнями. Чтобы проверить свои догадки в экспериментах на клеточных культурах, ученые отобрали 13 мутантных генов. В 12 из 13 случаев мутантные белки в основном оказывались в ядрышке. При этом половина из протестированных белков нарушала функции ядрышка, то есть механизм заболевания был схож с механизмом развития синдрома BPTAS.
Ученые считают, что результаты их работы помогут определять причины разных генетических заболеваний в будущем. Однако, к сожалению, новые знания все еще не обещают, что в ближайшее время будет разработано лекарство от синдрома BPTAS. Это связано с тем, что нарушения начинаются уже в зародыше, и тогда действовать лекарствами пришлось бы сразу на него. Тем не менее новые сведения могут быть полезны в онкологии, так как нарушения в работе клеточных конденсатов связаны с развитием рака. В случае раковых опухолей эта информация уже может быть полезна для разработки таргетной терапии.
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.