
Нобелевскую премию, лауреатов которой объявили сегодня, часто называют «премией по медицине». Однако Альфред Нобель в своем завещании специально уточнил, что приз должен вручаться именно «по физиологии или медицине», рассудив, что в том и другом направлении работают достойные ученые, исследования которых приносят человечеству ощутимую пользу. В 2024 году лауреатами премии стали Гэри Равкан и Виктор Эмброс «за открытие микроРНК и ее роли в пост-транскрипционной генной регуляции». Рассказываем, что именно выяснили американские ученые, как им в этом помог прозрачный червяк и почему научное сообщество сперва проигнорировало революционное открытие.
Как устроена Нобелевка по физиологии или медицине
С появления награды в 1901 году по начало 2024-го она вручалась 114 раз. Ее получили 227 человек, среди которых всего 13 женщин (первой в этом списке стала Герти Кори, разделившая ее со своим мужем в 1947 году). Самым молодым лауреатом стал 31-летний Фредерик Бантинг, разделивший премию за открытие инсулина 101 год назад, а самым пожилым — 87-летний Роус Пейтон, отмеченный «за открытие онкогенных вирусов» в 1966 году. При этом один человек не получал награду по физиологии или медицине дважды.
Среди стран по количеству лауреатов по этим дисциплинам с большим отрывом лидирует США, где награжденных около сотни, на втором месте — Великобритания, где награжденных втрое меньше.
Присуждает премию Нобелевская ассамблея из 50 профессоров Каролинского института в Швеции, которые собираются пять раз в году, чтобы обсудить номинированных кандидатов. Они избирают Нобелевский комитет из пяти человек и исполнительного секретаря из Каролинского института. Традиционно голосование за новых лауреатов проводится в первый понедельник октября. Затем с победителями по телефону связывается исполнительный секретарь Томас Перлманн.
Белки и клеточный «поиск себя»
В этом году заветный звонок раздался 7 октября в домах новых лауреатов: американских ученых Гэри Равкана и Виктора Эмброса. Они разделят премию с формулировкой «за открытие микроРНК и ее роли в пост-транскрипционной генной регуляции». Это один из фундаментальных принципов, определяющих активность каждого гена — то есть того, сколько белка синтезируется с него. Над этой темой исследователи работали вместе в Гарвардском университете. Лауреаты 2024 года не только коллеги, но и почти ровесники: будущий специалист по биологии развития Эмброс родился в Ганновере в 1953 году, а будущий молекулярный биолог Равкан — в Беркли в 1952-м.
В чем же суть их открытия? Наша ДНК — длинная молекула из двух закрученных по спирали цепей, которая хранится в клетке в виде хромосом. При помощи «букв» — нуклеотидов — в ней записаны инструкции, по которым нужно собирать каждый белок в нашем организме. Один ген обычно соответствует одному белку.
Но почему жизнь так зависит именно от белковых молекул? В наших клетках они удивительно разнообразны и выполняют миллионы ролей: они могут быть «строительным материалом», участвуют в сложных сетях взаимодействий, работают переключателями в процессах нашего организма, впускают внутрь и не выпускают наружу клетки различные вещества. Разные белки катализируют химические реакции, покрывают и защищают, смазывают и питают. Благодаря им сокращаются мышцы, кровь переносит кислород, глаза — получают световой сигнал, а иммунитет защищает нас от болезней.
Вот только каждой клетке не нужны все виды белков сразу: производить весь ассортимент было бы просто тратой ресурсов. Сотни типов клеток устроены по-разному: клетки эпителия кишечника покрыты ресничками и имеют мало общего с похожими на деревца нейронами, которые проводят нервный импульс, или с клетками на поверхности альвеол в легких. Эритроциты с вогнутыми боками при созревании избавляются от ядра, чтобы лучше переносить кислород, а половые клетки и вовсе имеют «половинчатый» набор хромосом. Все эти и многие другие типы так отличаются именно благодаря белкам, зависящим от выбранной клеткой «профессии». А значит, в определенных видах клеток требуется включение только определенных типов генов, а остальные должны «молчать». Действие микроРНК — совершенно новый механизм, который позволяет достичь этого разнообразия, чтобы каждая разновидность клеток производила те белки, в которых нуждается, становилась самой собой и не тратила силы и ингредиенты впустую. Сейчас науке известно около тысячи типов микроРНК в организме одних только людей, а сам принцип оказался универсальным для многоклеточных.
Знаменитый червячок и молодые постдоки
Но началась эта история в конце 1980-х, когда Виктор Эмброс и Гэри Равкан были постдоками в лаборатории Роберта Хорвица. Их руководитель, кстати, получил Нобелевскую премию в 2002 году, разделив ее с Сиднеем Бреннером и Джоном Салстоном. Они были отмечены за исследования апоптоза — программируемого клеточного «самоубийства». Лаборатория во главе с Хорвицом занималась с модельным организмом, который сейчас стал одним из самых знаменитых, — Caenorhabditis elegans, прозрачным червячком-нематодой длиной всего в миллиметр. Несмотря на скромный размер, это животное может похвастаться специализированными типами клеток, которые имеются и у более крупных и высокоразвитых существ, — в том числе нервными и мышечными. Изучение Caenorhabditis elegans обеспечило исследователям прозрачность прямом и переносном смысле: благодаря ему удалось проследить развитие каждого типа их клеток, а позднее — вплоть до судьбы каждой отдельной клетки!
Момент, когда запустится развитие каждого типа клеток, у этого червячка определяется включением и выключением различных генетических программ. От этого зависит, смогут ли нужные типы клеток созреть и заработать в нужное время. Виктор Эмброс и Гэри Равкан изучали две линии нематод, одна из которых имела мутацию гена lin-4, другая — lin-14.
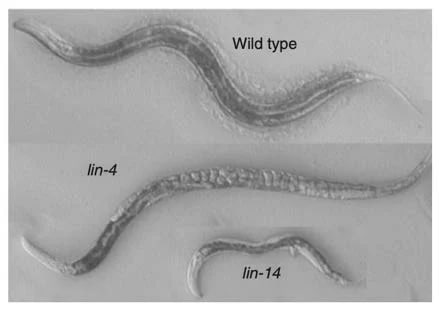
Нематоды дикого типа в сравнении с мутантами по lin-4 и lin-14
Мутанты по lin-4 открыл Сидней Бреннер в 1970-х. У них отсутствовали многие типы клеток и морфологические структуры, а яйца накапливались внутри, так как половые органы не были полностью сформированы. Предполагалось, что ген lin-4 регулировал время «включения» и выключения разных программ развития в нужное время. Мутанты по гену lin-14 тоже вырастали с отклонениями, которые свидетельствуют о неправильном старте формирования разных типов клеток, а личиночные программы развития словно бы полностью отсутствовали. При этом нарушения у двух мутантов казались противоположными. Незадолго до этого Эмброс выяснил, что работа гена lin-14 подавляется геном lin-4. Исследователям хотелось понять, как блокируется ген lin-14 — этот механизм не был известен науке. Поэтому после работы постдоком Виктор Эмброс в новой лаборатории в Гарварде занялся кропотливым клонированием нематод, выключая им различные гены. Так он создал «карту» генов и определил, зачем они нужны. Однако функция lin-4 удивила ученого: этот участок ДНК производил необычно короткую РНК, которая и заставляла «замолчать» ген lin-14. Эмброс ломал голову над тем, как именно это происходит, но гены хранили молчание.
Гэри Равкан не отставал от коллеги в продвижении по карьерной лестнице: он тоже открыл свою лабораторию, только при Массачуссетской больнице общего профиля, и тоже занялся lin-14. Он продемонстрировал, что «выключает» его не микроРНК от гена lin-4 — или, по крайней мере, не делает это напрямую. Она не прилепляется к гену как «заглушка», не режет его, словно ножницы, не мешает расплести нужный для копирования участок ДНК с инструкциями и не блокирует итоговый белок (на подобное способны другие механизмы).
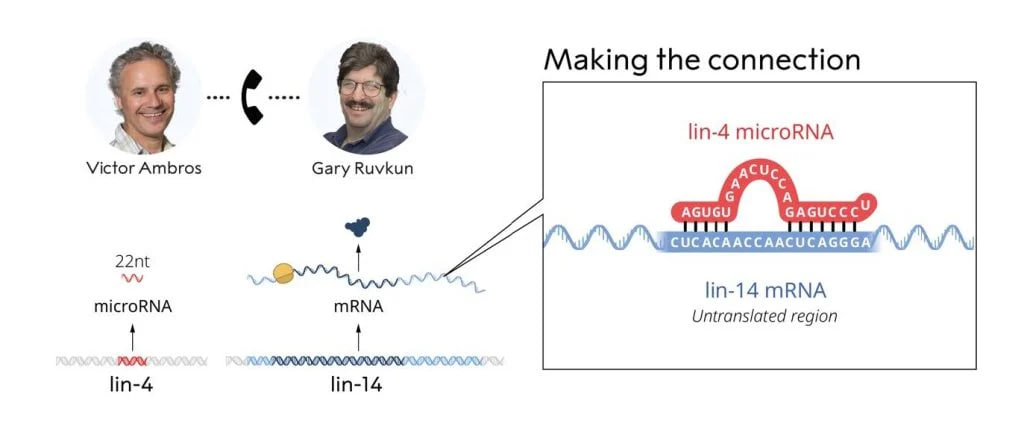
Комплементарные участки мРНК и микроРНК связываются друг с другом, как оказались связаны исследования Эмброса и Равкана
Когда Эмброс и Равкан сопоставили результаты, они пришли к революционному открытию. Эксперименты показали, что в «замолкании» lin-4 участвует сегмент матричной РНК (мРНК, или своеобразной копии гена, которая выходит из ядра клетки, чтобы стать матрицей для сборки белка) с гена lin-14. Короткая последовательность гена lin-4 соответствовала комплементарной (то есть парной ей) последовательности в мРНК с lin-14. На этапе, когда с гена производится матричная РНК, микроРНК объявляет «план-перехват», чтобы белок все-таки не появился. Так что новым механизмом выключения гена оказалось связывание этих РНК друг с другом. Две статьи об открытии вышли в журнале Cell в 1993 году.
Звенящая тишина и громкий успех
Парадоксально, но на механизм, заставляющий гены «замолчать», научное сообщество отреагировало полным молчанием. Сейчас он считается разновидностью очень распространенного процесса, который красноречиво называется silencing, что буквально и переводится как «замолкание». Тогда же он казался особенностью маленького червячка, но никак не общим правилом. Однако биологов это не остановило. В 2000 году группа Равкана описала, как микроРНК «перехватывает» матричную РНК древнего, эволюционно консервативного гена let-7, распространенного среди большинства групп животных. Эта работа стала искрой, от которой наконец-то разгорелось пламя: вскоре список известных микроРНК пополнился сотнями новых молекул.
Параллельно несколько научных групп трудились, чтобы прояснить, как производится микроРНК и как она достигает своей цели — последовательности на мРНК. После их связывания мРНК становится неспособна производить белок или разрушается. При этом оказалось, что одна и та же микроРНК может заставить замолкать много разных генов, а еще на один и тот же ген может влиять много разных микроРНК. Механизмы для производства микроРНК позволяют клеткам животных и растений создавать и другие малые РНК-молекулы — например, чтобы помочь растениям в борьбе против вирусных инфекций. Эти процессы, названные РНК-интерференцией, или сайленсингом, исследовали Эндрю Файр и Крейг Мелло, за эту работу тоже получившие Нобелевскую премию, но в 2006 году.
Нарушения работы микроРНК могут приводить к развитию рака, врожденной тугоухости, проблемам со зрением и формированием скелета. Мутация одного из белков, нужных для производства микроРНК, вызывает синдром DICER1 — редкое, но тяжелое состояние, из-за которого в органах и тканях образуются многочисленные опухоли даже в молодом и детском возрасте.
Этот случай — яркий пример того, как, на первый взгляд, незначительный механизм, забавный частный случай, может оказаться одним из важных клеточных процессов, который работает у многоклеточных сотни миллионов лет. Без него клетки не могли бы нормально развиваться и следовать пути выбранной «профессии» — как и в человеческой жизни, для этого необходимо правильно расставить приоритеты и от чего-то отказаться. Поэтому перед тем, как посмотреть свысока на, казалось бы, никак не связанное с реальной жизнью фундаментальное исследование, узнайте, за сколькими прорывами на самом деле стоит изучение мельчайших деталей работы клеток скромных червячков и мушек длиной миллиметр или два.
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.





