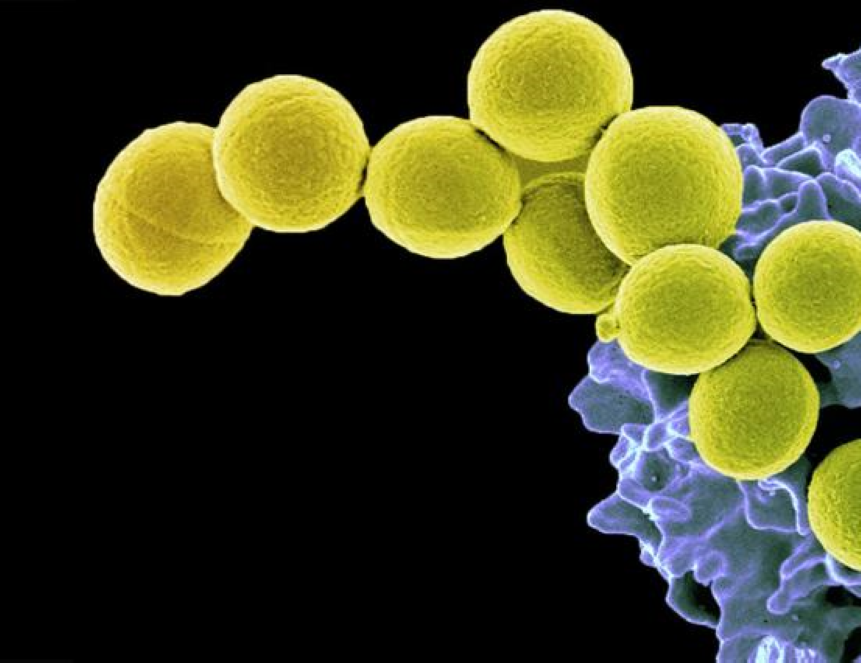
Исследователи из России, Германии и Франции вместе с сотрудниками фармацевтической компанией NovAliX смогли расшифровать один из механизмов устойчивости золотистого стафилококка — бактерии, являющейся причиной большого количества инфекционных заболеваний. С результатами исследований можно ознакомиться в статье журнала Nature Communications.
Исследователи описали механизм выживания клеток бактерий во время стресса, под воздействием которого микроорганизмы переходят в особое состояние с пониженным потреблением энергии, чтобы переждать неблагоприятные условия. В 2016 году та же группа ученых впервые смогла получить структуру рибосомы золотистого стафилококка в высоком разрешении и показать отличия ее строения от других организмов.
На данный момент ученые ищут белки, управляющие работой рибосомы патогена. Для этого они используют методы генетики, биохимии, молекулярной биологии и биофизики. Исследования в этой области ученые начали пять лет назад. Долгое время им не удавалось получить структуру комплекса бактериальных рибосом с белком RsfS в высоком разрешении. Теперь сделать это удалось, и с помощью нового исследования ученые могут понять детали механизма развития устойчивости.
«Рибосома — это крупнейший рибонуклеиновый комплекс в клетке, она состоит из двух субъединиц: большой и малой. Малая субъединица отвечает за прочтение генетического кода, а большая часть обеспечивает образование пептидной связи в растущей цепи белка, — объясняет один из исследователей, руководитель научно-исследовательской лаборатории «Структурная биология» Института фундаментальной медицины и биологии Казанского федерального университета Константин Усачев. — Мы с помощью методов криоэлектронной микроскопии и рентгеноструктурного анализа смогли показать механизм связывания с рибосомой белка RsfS, который защищает золотистый стафилококк от стресс-факторов, таких как антибиотики, повышенная температура и иммунная система хозяина. В условиях стресса этот белок связывается с большой субъединицей рибосомы и не дает присоединиться малой субъединице, препятствуя формированию функциональных рибосом».
Одной из проблем в работе была высокая токсичность этого белка для бактерий E. coli — организма, используемого для получения протеинов в лабораторных условиях. Это случилось потому, что RsfS способен останавливать синтез белков во всех бактериях. Это приводило к получению очень малого количества образца белка, недостаточного для проведения структурных исследований. Кроме того, образец был крайне нестабилен и образовывал агрегаты. Тогда исследователи разработали новый способ и смогли выделить данный белок одновременно с его мишенью в структуре рибосомы стафилококка — белком L14, который входит в состав большой субъединицы.
Оказалось, что если выделять обе компоненты одновременно, то ни будут стабильными в растворе. Ученым удалось получить кристаллы этих белков и найти структуру полученного материала методом рентгеноструктурного анализа сначала со средним разрешением с помощью обычного монокристального дифрактометра, а затем с высоким разрешением — на синхротроне ESRF в Гренобле.
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.