Американские биологи из Массачусетского технологического института разработали скрининговый метод, который позволяет идентифицировать участки белков, способные связываться с тем или иным белком. Подобные белок-белковые взаимодействия могут быть использованы для лечения различных болезней, в том числе рака. Научные статьи, описывающие результаты исследования, опубликованы в журнале eLife.
В каждой клетке содержатся миллионы разных молекул, способных связываться друг с другом для выполнения своих функций. В человеческом геноме закодировано около 20 тысяч белков, большинство из которых способны связываться друг с другом и участвовать таким образом в около 400 тысячах различных взаимодействий. Белки связываются друг с другом не случайным образом, а только в специфических участках молекулы. Если образуется неправильная пара белков или правильная пара в неправильном месте, то в организме может развиться рак или другие заболевания. Поэтому так важно изучать белок-белковые взаимодействия, которые могут быть использованы для лечения болезней.
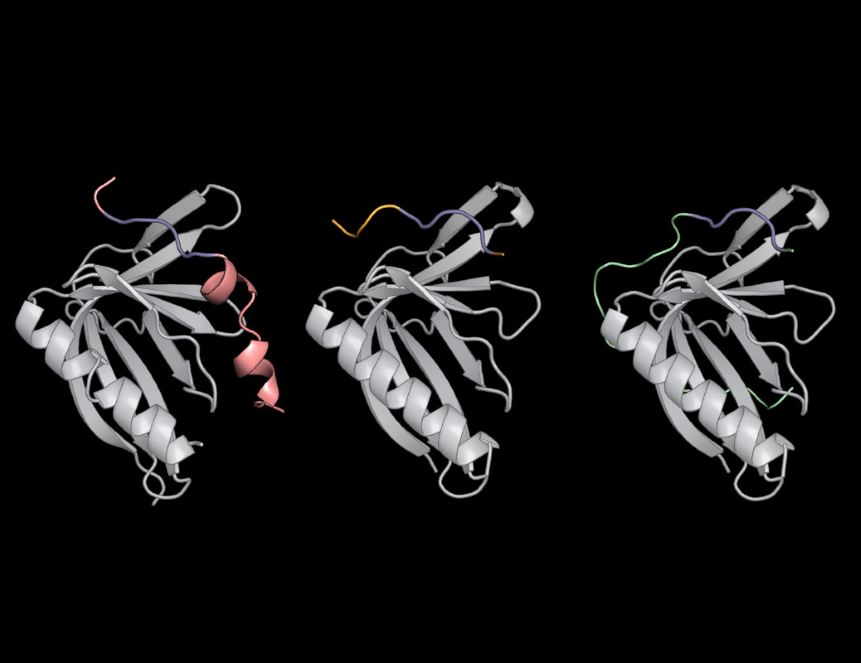
Американские ученые исследовали короткие линейные мотивы (SLiM, КЛМ) — последовательности из 4–6 аминокислот, которые как бы отделяются от общей 3D-структуры белка и участвуют в связывании с другими молекулами. До сих пор биологи не до конца понимали, как именно КЛМ распознают нужные для связывания белки. Исследователи разработали метод скрининга MassTitr, который способен отыскать все потенциальные КЛМ для конкретного белка. Особенностью этого метода является то, что с его помощью можно отыскать КЛМ с разным сродством к белку, а не только те КЛМ, которые связываются с ним сильно. Ученые также предположили, что в связывании двух белков могут участвовать аминокислоты на обоих концах последовательности КЛМ.
Чтобы проверить эту гипотезу, биологи использовали свой метод MassTitr и отыскали в человеческом протеоме потенциальные КЛМ, которые могли бы связаться с белком ENAH. ENAH — это белок, который участвует в движении клеток. Для здоровых клеток подвижность — это жизненно важная способность, а раковые клетки способны ей злоупотреблять и за ее счет распространяться в другие ткани. При снижении уровня белка ENAH в клетке раковые опухоли хуже разрастаются.
С помощью метода MassTitr ученые идентифицировали 33 белка, содержащих КЛМ, которые способны связываться с ENAH. 19 из них были описаны в таком контексте впервые. Исследователи также обнаружили три концевых паттерна аминокислот, присутствие которых в КЛМ повышало сродство белка к ENAH. Один из белков, содержащий подобный паттерн, называется PCARE, и его сродство к ENAH оказалось самым сильным среди всех белок-белковых взаимодействий, опосредованных через КЛМ и описанных на сегодняшний день.
Далее ученые воспользовались компьютерной программой dTERMen. С ее помощью они интерпретировали данные, полученные с помощью метода рентгеновской кристаллографии. Биологи хотели выяснить, почему PCARE связывается именно с ENAH, а не с практически идентичными ему белками VASP и EVL. Как оказалось, концевые аминокислоты в КЛМ PCARE взаимодействуют с белком ENAH, заставляя его немного изменить свою пространственную конфигурацию. В результате сайты связывания двух белков подходят друг к другу ближе. Когда рядом с PCARE находятся белки VASP или EVL, таких структурных изменений не происходит, поэтому эти белки и не связываются друг с другом.
Вдохновившись этим взаимодействием между PCARE и ENAH, исследователи разработали собственный искусственный белок, который специфически связывается с ENAH с высоким сродством. Ученые считают, что проделанная ими работа заложила фундамент для создания синтетических молекул, способных нарушать белок-белковые взаимодействия, которые замешаны в развитии тех или иных заболеваний. Биологи планируют и далее изучать ENAH вместе с другими белками, которые связываются друг с другом посредством КЛМ.
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram
Подписывайтесь на InScience.News в социальных сетях: ВКонтакте, Telegram, Одноклассники.





